Un elettrone ruota attorno ad un atomo come un pianeta attorno al sole. Nel caso più semplice di un elettrone che ruota attorno al nucleo di moto circolare uniforme, si osserva che l'elettrone è in grado di rimanere in orbita attorno al nucleo solo se la forza centripeta risulta essere controbilanciata dalla forza centrifuga dovuta allo stesso moto circolare uniforme.
Forza centripeta = Forza elettrostatica = K e2 / R2
Forza centrifuga = m V2 / R
In queste condizioni esso potrebbe stazionare a qualsiasi distanza dal nucleo, ma questo contrasta sia con quanto previsto dalla teoria sia dagli eventi sperimentali.
-
Un elettrone che accelera in un campo elettrico deve perdere energia e di conseguenza cadere sul nucleo dopo pochi secondi.
-
Un elettrone che perde energia trasferisce la stessa a un fotone di energia hν, energia pari a quella persa dall'elettrone, quindi lo spettro dell'atomo d'idrogeno dovrebbe essere continuo e non a righe come verificato sperimentalmente.
Bohr e la quantizzazione del momento angolare
Per superare quanto sopra contestato, Bohr ha ipotizzato che, per motivi non meglio precisati, un elettrone può permanere indefinitamente solo su orbite che rispettano le seguenti condizioni:
-
K e2 / R2 = m V2 / R
-
mVR = n h (quantizzazione del momento angolare)
Imponendo tali condizioni si ricava:
K e2 / R2 = m V2 / R
K e2 = m V2 R
m K e2 R = ( m V R)2 = (nh)2
R= n2 [ h2 / (m K e2)] = n2 R0
essendo i termini racchiusi tra le parentesi quadre tutti associati a costanti si ricava che il raggio ossia la distanza dal nucleo in cui si può trovare un elettrone risulta essere proporzionale a n ( numero appartenente a N) al quadrato.
L'energia totale di tale elettrone è pari alla metà dell'energia potenziale e quindi:
E(n)= - 1/2 K e2 / R = - 1/n2 [ 1/2 m K2 e4 / h2] ossia inversamente proporzionale all'inverso del quadrato di n.
L'energia rilasciata da un elettrone che passa da un livello n2 a un livello n1 con la creazione di un fotone di energia hν = E(n2) -E(n1)
ν= RH( 1/n12 -1/n22) si osserva sperimentalmente quando consideriamo l'atomo di idrogeno.
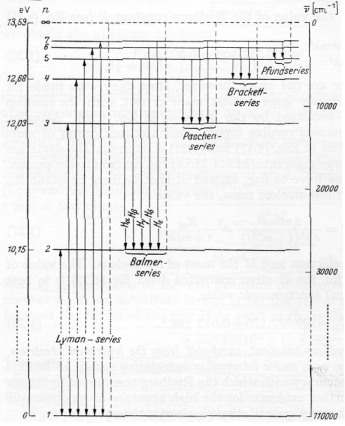
Quanto ricavato non vale per gli altri atomi. Perchè?
Perché si deve quantizzare il momento della quantità di moto?