SISTEMI TERMODINAMICI
Finora ci siamo occupati della microfisica, cioè della struttura
delle molecole, degli atomi, dei nuclei atomici e dei fenomeni che si
verificano a tali livelli.
Infatti, per studiare la dinamica, abbiamo considerato singoli corpi
che si muovono nello spazio. Per studiare la termodinamica, dobbiamo
invece parlare di macrofisica, poiché ci occupiamo del movimento
di un insieme di corpi.
Un sistema è una determinata quantità di materia racchiusa
entro un contorno. La distinzione in sistema aperto e in sistema chiuso
si riferisce al fatto che ci sia o no scambio di materia tra il sistema
e l'ambiente. Si dice invece che un sistema è termicamente isolato
quando non si ha scambio di calore tra il sistema e l'ambiente.

Chiameremo gas ideale o gas perfetto quel gas le cui molecole sono assimilate a punti geometrici (volume proprio uguale a zero) e tra le quali non agisce alcuna forza intermolecolare (potenziale interno uguale a zero).
Le grandezze macroscopiche utilizzate per studiare un gas ideale contenuto in un recipiente sono:il volumeoccupato dallo stesso, la pressione esercitata sulle pareti, la temperatura e il numero di moli presenti nel recipiente.
Sperimentalmente si sono verificate leseguenti leggi:
Legge di Boyle
A temperatura costante, il valore del prodotto della pressione per
il volume del gas è costante.
pV=K con T costante
Legge di Charles
Se si mantiene costante la pressione, il volume di una massa di gas
è collegato alla temperatura dalla seguente relazione:
V= Vo (1+ α t) con p costante
dove:
Vo |
volume occupato dal gas a O°C |
t |
temperatura del gas in gradi Celsius |
α |
1/273,15 |
Legge di Gay-Lussac
Se il volume del gas è costante, la pressione del gas varia secondo la relazione:
p= po (1+ α t) con V= costante
dove:
Po |
pressione del gas a O°C |
t |
temperatura del gas in gradi Celsius |
α |
1/273,15 |
Le leggi di Charles e di Gay-Lussac si possono esprimere in un altro modo, introducendo la temperatura assoluta della scala delle temperature assolute, misurate in gradi Kelvin.
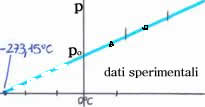 Dalla legge di Gay Loussac si estrapola che alla temperatura di -273,16°
C il gas esercita una pressione nulla sulle pareti, ossia non è
in grado di agire in alcun modo nel mondo esterno. Si può presumere
che questa sia la temperatura minima che possa essere raggiunta da tutti
gli atomi e molecole presenti nell'universo.
Dalla legge di Gay Loussac si estrapola che alla temperatura di -273,16°
C il gas esercita una pressione nulla sulle pareti, ossia non è
in grado di agire in alcun modo nel mondo esterno. Si può presumere
che questa sia la temperatura minima che possa essere raggiunta da tutti
gli atomi e molecole presenti nell'universo.
Chiamando tale temperatura zero assoluto, possiamo introdutte una temperatura "assoluta" con T= tc+ 273.15.
Pertanto risulta: O°C= 273,15 K
Misurando la temperatura in gradi assoluti possiamo riscrivere le leggi precedentemente introdotte così.
V = Vo (1+ αt) diventa V= Vo T/To
P = Po (1+ α t)diventa P= PoT/To
da questo si ricava l'equazione di stato dei gas perfetti.
Equazione di stato dei gas perfetti
Combinando le leggi ricavate si ottiene: p V /T= costante
pV/T= N KB
dove: N= numero di molecole nel gas
KB= 1,38*10-23 J/K (costante di Boltzmann)
L'equazione di stato dei gas perfetti si può anche scrivere:
pV= nRT
dove: R=N KB/n = 8,31 J/mol K (costante universale dei gas)